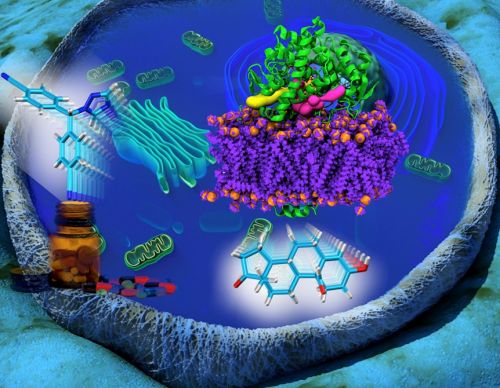
Il tumore al seno è tra i più frequenti nelle donne in Italia e nel mondo. Oggi però sembra possibile progettare farmaci più selettivi e più efficaci grazie alle simulazioni numeriche. Lo rivela una ricerca della Scuola internazionale superiore di studi avanzati (Sissa) e dell’Istituto officina dei materiali del Consiglio nazionale delle ricerche di Trieste (Iom-Cnr), svolta in collaborazione con l’Istituto di ricerca in biomedicina di Bellinzona (Irb) e con l’Università di Lugano, che ha analizzato in dettaglio i meccanismi di attivazione di un importante target farmacologico, superando così i limiti degli approcci sperimentali.
Lo studio, che ha dimostrato come molecole di forma e dimensione diverse percorrano le stesse strade all’interno della proteina per accedere al sito attivo ossia il cuore della proteina dove vengono sintetizzati gli ormoni femminili, è stato pubblicato sul Journal of Physical Chemistry Letters e finanziato dall’Associazione italiana per la ricerca sul cancro (Airc).
“I citocromi P450 sono enzimi che hanno un ruolo fondamentale nel metabolismo di diversi ormoni e farmaci. In particolare, sono importanti target farmacologici nella cura dei tumori al seno e alla prostata”, spiega Alessandra Magistrato, ricercatrice Iom-Cnr/Sissa e prima autrice del lavoro insieme a Jacopo Sgrignani dell’Irb di Bellinzona. “Da tempo si sa che sono caratterizzati da un sito di attivazione nascosto ma raggiungibile attraverso numerosi canali di accesso di cui non si sa ancora la reale funzione. Abbiamo scelto l’aromatasi come prototipo della famiglia dei citocromi P450 e confrontato i percorsi di accesso di due molecole differenti per forma, dimensione e idrofobicità – cioè la tendenza a interagire con l’acqua”.
L’aromatasi è un enzima responsabile per la sintesi degli ormoni sessuali femminili, la cui eccessiva produzione è tra le cause dello sviluppo dei tumori al seno. Nello studio, guidato da Alessandra Magistrato dello Iom-Cnr/Sissa e da Andrea Cavalli dell’Irb di Bellinzona e svolto in collaborazione con Rolf Krause dell’Università della Svizzera italiana, i ricercatori hanno confrontato un farmaco antitumorale di ultima generazione, inibitore dell’aromatasi stessa, e un ormone su cui agisce l’enzima.
“Attraverso simulazioni di dinamica molecolare classica, che permettono di studiare l’evoluzione dei processi a livello atomistico”, spiegano i ricercatori, “abbiamo individuato e caratterizzato dal punto di vista energetico i percorsi di accesso preferenziali delle due molecole per raggiungere il sito catalitico dell’enzima. Sorprendentemente abbiamo identificato gli stessi due canali in entrambi i casi, indipendentemente quindi dalla diversa forma, dimensione o idrofobicità delle due molecole studiate. Inoltre, la somiglianza tra diversi citocromi P450 nei punti critici fa supporre che questa caratteristica possa essere comune a tutta la famiglia enzimatica”.
Risultati notevoli per le future applicazioni farmaceutiche. “Si tratta di risultati che non sono osservabili sperimentalmente e che però sono fondamentali per lo sviluppo di farmaci più selettivi e più efficaci”, conclude Alessandra Magistrato.
Lo studio è infatti parte di un progetto ‘My First AIRC’, finanziato alla ricercatrice Iom-Cnr/Sissa dall’Airc, per la progettazione, sintesi e sperimentazione di nuovi farmaci antitumorali per combattere in cancro al seno.